Калиевая соль хлорноватой кислоты, или хлорат калия, представляет собой неорганическое соединение, обладающее взрывчатыми свойствами. Высокая чувствительность к трению и реакционная способность ограничивают область его применения в промышленности.
Общее описание
Хлорат калия – твердое вещество в виде кристаллического мелкого порошка белого цвета, не имеющего запаха. Кристаллы обладают пластинчатой, игольчатой или призматической формой. Другое название этого соединения – бертолетова соль. Оно присвоено по имени французского химика Клода Луи Бертолле. Этот ученый впервые синтезировал данное вещество в 1786 году с помощью пропускания хлора через раствор калиевого щелока. Тогда же были открыты и его взрывчатые свойства.
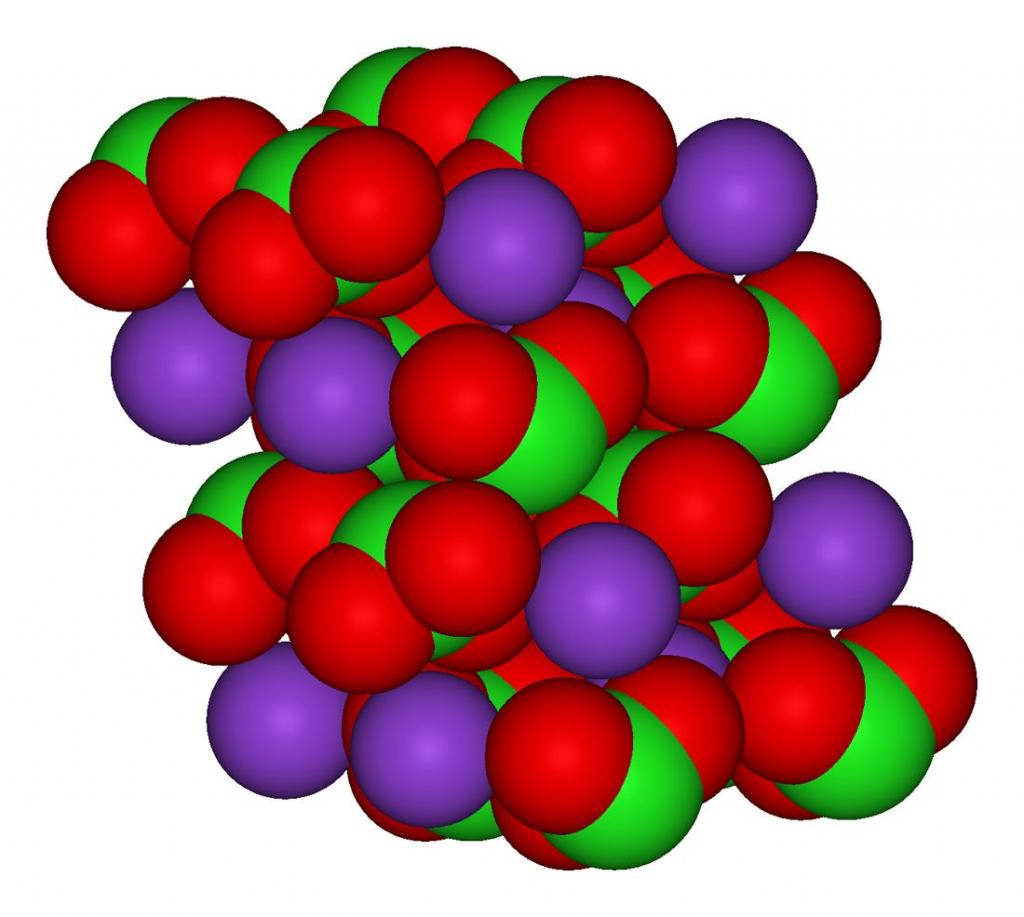
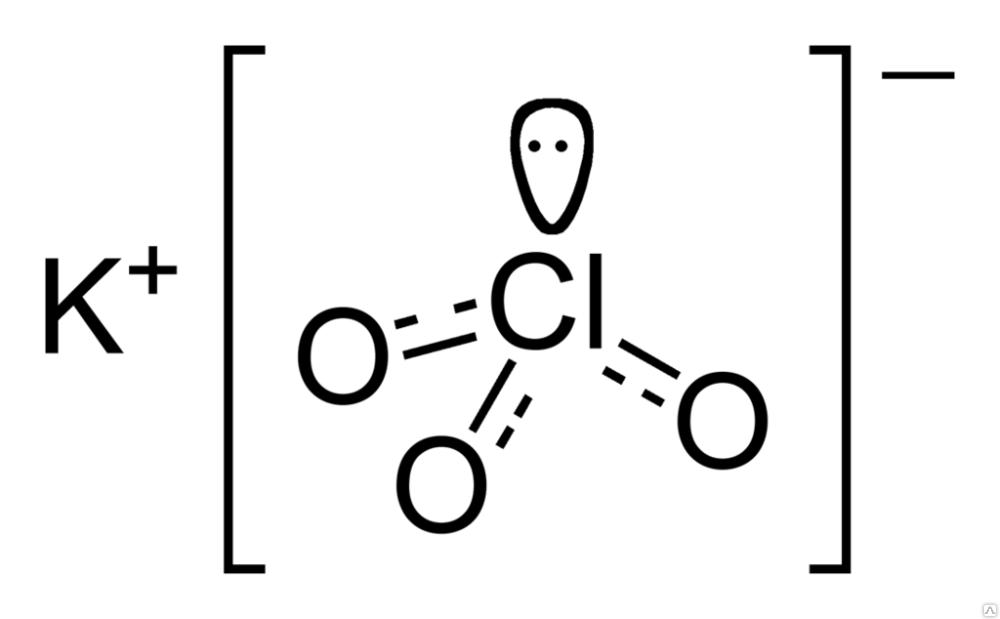
Эмпирическая формула хлората калия имеет вид: ClKO₃.
Структурно вещество представлено на рисунке ниже. Три атома кислорода связаны с атомом хлора посредством ковалентной связи, а взаимодействие атома калия и хлора носит ионный характер.
По химическому составу компоненты распределяются таким образом:
- К – 31,92 %;
- Cl – 28,92 %;
- О – 39,16 %.
Химические свойства
Хлорат калия является сильным окислителем. Это свойство использовалось для получения пороха. Данное соединение может «поджечь» многие вещества, поэтому при работе с ним требуется аккуратность.

Данное соединение характеризуется следующими основными химическими свойствами:
- При нагреве до 400 °С происходит его разложение с выделением кислорода и образованием перхлората калия.
- При дальнейшем нагреве происходит выделение О2 и KCl.
- В реакции с сернокислым аммонием в водно-спиртовом растворе наблюдается образование высокобризантного (имеющего большую способность к разрушению) и чувствительного вещества – хлората аммония (NH₄ClO₃).
Интересной особенностью является то, что разложение хлората калия протекает с выделением теплоты, а перхлората – с поглощением ее. У перхлоратов также выше температура воспламенения. Данный факт является преимуществом в обращении с ClKO₄.
Физические свойства
Если в порошке присутствуют примеси Mn, CuO, Fe2O3 Cr2O3 и другие оксиды, то температура разложения сильно снижается (до 200 °C).
Основные физические свойства хлората калия перечислены ниже:
- температура плавления – 356 °C;
- температура кипения – 400 °C;
- гравиметрическая плотность – 2100-2250 кг/м³;
- кристаллическая плотность – 2340 кг/м³;
- молярная масса – 122,594 г/моль;
- растворимость в воде – хорошая (69,9 г /л при температуре 20 °C).
Получение
В химической промышленности синтез хлората калия производится при помощи дисмутации солей хлорноватистой кислоты HClO (реакция самоокисления-самовосстановления). Наиболее распространенным способом является обмен между Ca(ClO₃)₂ и KCl.
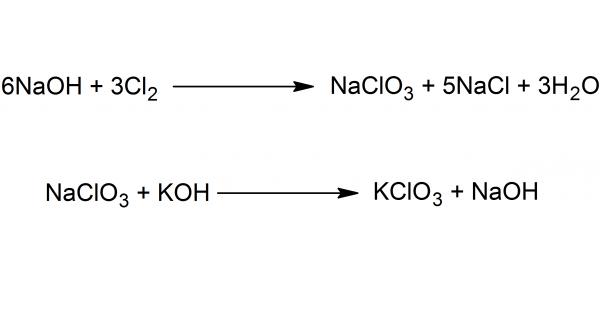
На рисунке ниже представлена схема получения вещества в два этапа - пропусканием хлора через раствор едкого натра с последующей обменной реакцией между хлоратом натрия и каустическим поташем.
Существуют и другие методы – термическое разложение гипохлорита калия, электрохимический метод (электролиз водных растворов хлоридов).
Влияние на живые организмы
Хлорат калия является токсичным веществом. Отравление этим соединением приводит к появлению следующих симптомов:
- при попадании в ЖКТ: боль в эпигастрии, тошнота, рвота;
- при поражении глаз или кожи: раздражение, покраснение;
- при попадании в органы дыхания: кашель, болезненные ощущения, затрудненное дыхание.
Смертельная доза – 1г/кг. Вещество токсично для флоры и фауны природных водоемов.
В качестве первой помощи пострадавшему необходимо предпринять следующие меры:
- вывести на свежий воздух;
- промыть кожу (глаза) чистой водой;
- прополоскать рот водой;
- снять загрязненную одежду.
Меры безопасности
При хранении вещество необходимо беречь от источников тепла и открытого огня. В помещении нельзя курить. Не допускается смешивать соединение с горючими материалами, так как это может привести к взрыву.
При воспламенении хлората калия огонь тушат песком, углекислотой в порошковых огнетушителях. Если произошло возгорание большого количества вещества, то необходимо покинуть опасную зону.
Изготовление взрывчатых веществ
В конце XIX – начале XX века хлорат калия использовался в качестве взрывчатого вещества. На его основе изготавливался так называемый «порох Бертолле», состав которого включал 75 % бертолетовой соли и по 12,5 % серы и угля. В отличие от обычного черного пороха, сделанного из калиевой селитры, данная химическая композиция имеет очень высокую чувствительность к механическому воздействию. От трения или удара порох Бертолле может загореться или взорваться. И хотя по мощности он превосходил все известные виды взрывчатых веществ в то время, химическая неустойчивость предопределила его ограниченное применение. В Швейцарии для повышения безопасности взрывчатых веществ, используемых при строительстве шахт, хлоратные соединения желатинировали.
Во время Первой мировой войны хлорат калия использовался в составе других видов взрывчатых веществ. Так, в Германии успешно применялась «силезия» (80 % ClKO₃ и 20 % смолы, обработанной азотной кислотой). В Австрии такие составы включали ClKO₃ и антраценовое масло. Постепенно хлорат калия, как составной элемент взрывчатых смесей, был вытеснен хлоратом натрия. В 1941-1945 гг. данное соединение входило в терочный состав немецких ручных гранат.
Другие области применения
В настоящее время хлорат калия иногда используется в качестве источника хлора в пиротехнических составах для получения цветного огня. Благодаря ему фейерверк горит интенсивнее и не ослабевает под давлением воздуха. Поэтому данное соединение применяют для ракет-форсов.

Бертолетова соль имеется также в составе спичечных головок. Если соскоблить вещество, собрать его в виде горки на твердом основании и стукнуть молотком, то можно наблюдать явление микровзрыва. Этот пример наглядно иллюстрирует исключительную чувствительность и опасность использования хлората калия.
Данное вещество применялось также некоторое время в качестве антисептического средства для полоскания рта и горла. После того, как были выявлены его токсические свойства, его перестали использовать в медицинских целях.

























А ЧТО ВЫ ДУМАЕТЕ ОБ ЭТОМ?